Conteúdo do módulo
2. Tipos de polimorfismo genético
Existem várias categorias de polimorfismo genético, cada uma das quais possui mecanismos de origem e aplicações específicas que dependem das suas características. Podemos diferenciar:
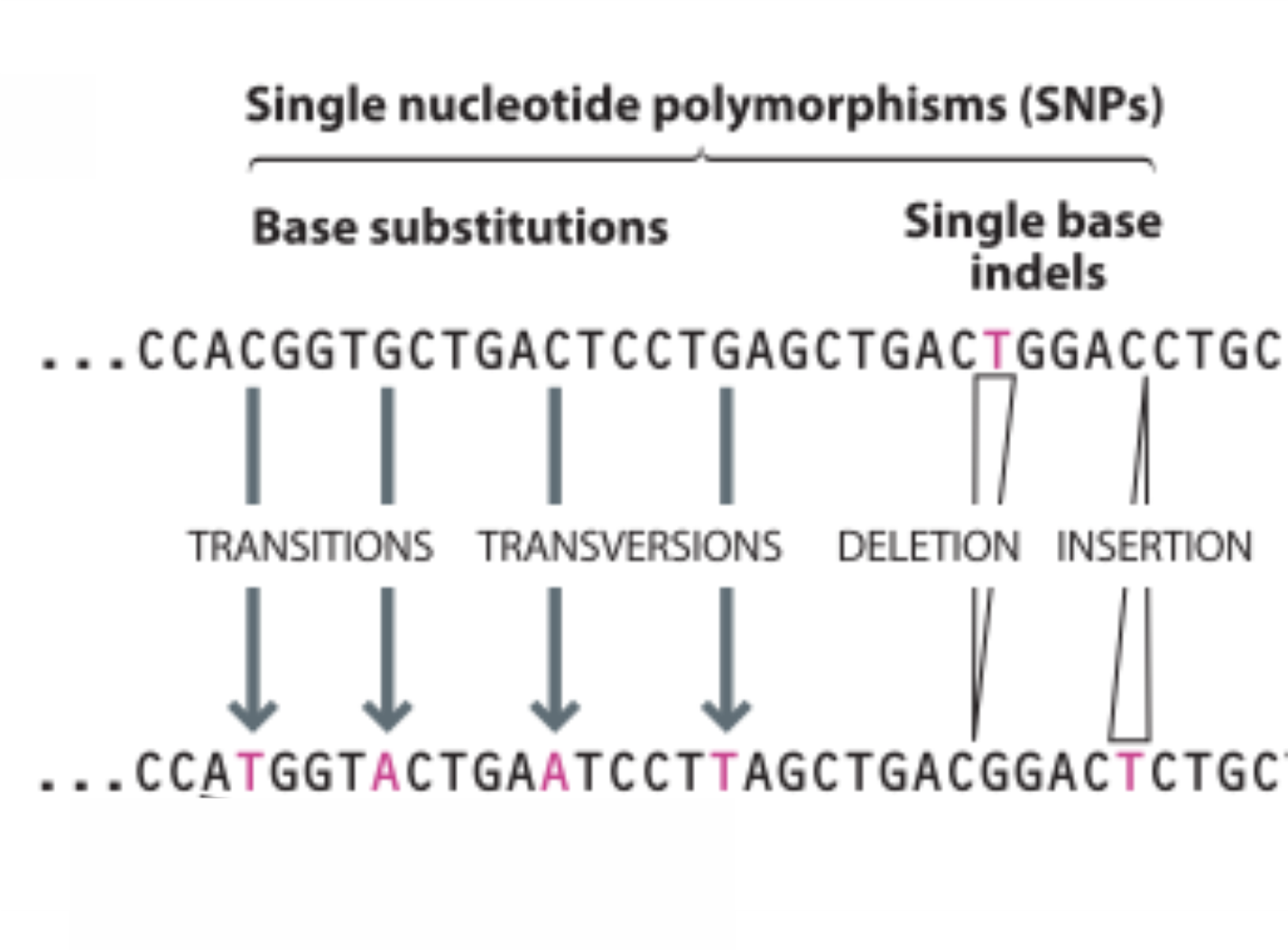
Polimorfismo de nucleotídeo único: ou SNPs, do inglês Single Nucleotide Polymorphisms. Nessa categoria incluímos substituições ou indels (inserção/deleção) de uma única base.
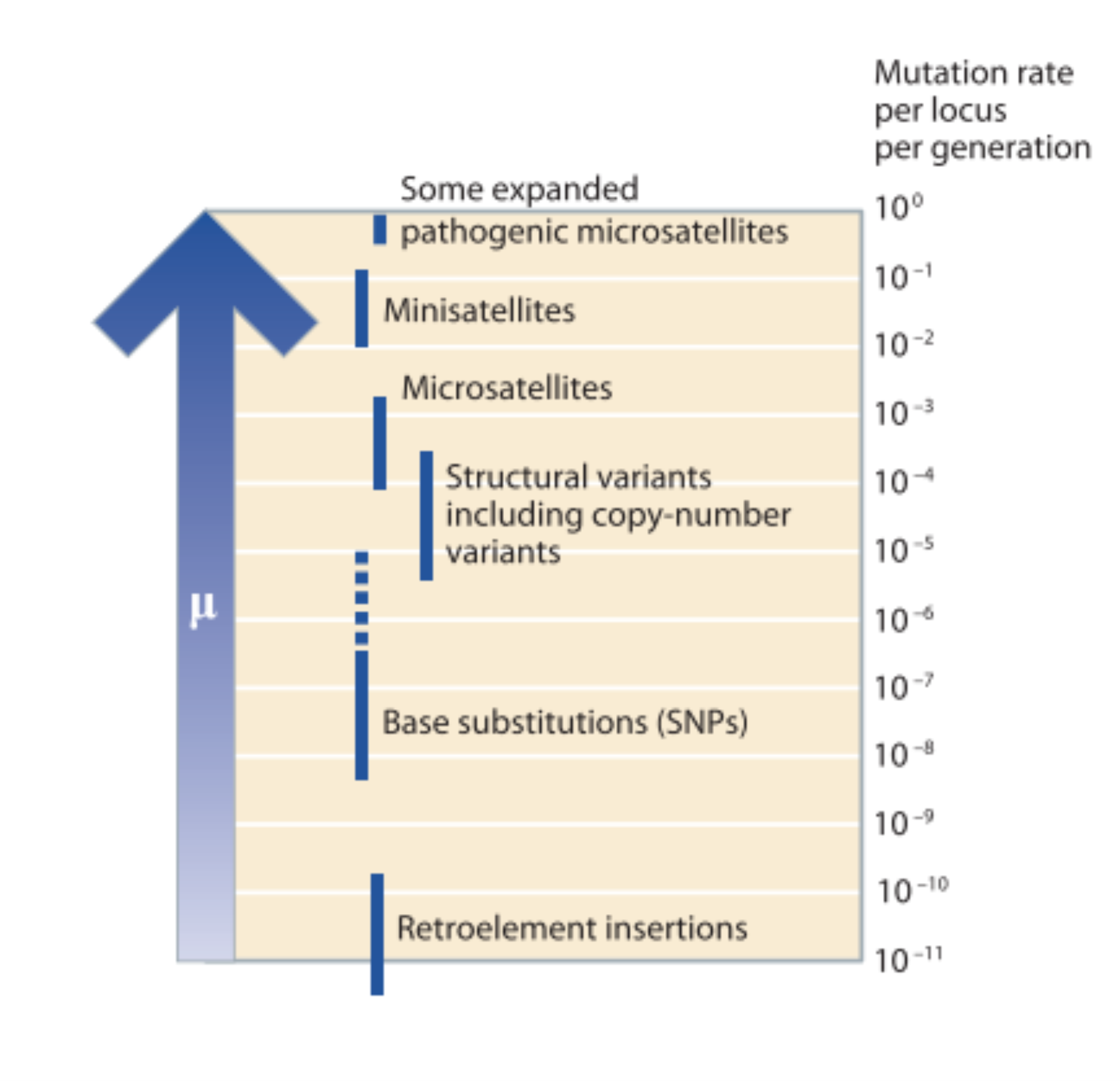
Polimorfismo de número variável de repetições em tandem: ou VNTRs, do inglês Variable Numer of Tandem Repeats. Essa categoria abrange sequências que mudam no número de cópias de um fragmento repetitivo. Por sua vez, as VNTR podem ser classificadas em: satélites (a sequência repetida possui >= 100 pb), minissatélites (8-100 pb) e microssatélites (a sequência repetida possui 1-7 bp).
Elementos transponíveis: também chamados elementos moveis ou elementos repetitivos dispersos. São sequências que inserem cópias de se mesmas em outras partes do genoma. Elas compõem 45% do genoma humano.
Variantes estruturais: este grupo inclui inversões e translocações balanceadas ou não balanceadas (como indels) que abrangem fragmentos maiores a 1kb.
Das categorias mencionadas, SNPs, microssatélites e algumas classes específicas de elementos transponíveis são amplamente utilizadas na genética de populações devido a sua maior facilidade de estudo. Uma característica importante dos distintos polimorfismos que afeta enormemente a sua aplicabilidade nas distintas áreas da genética é a sua velocidade de mutação. A velocidade de mutação de um polimorfismo permitirá que ele seja utilizado, ou não, para identificar variação no nível inter-individual (diferenças entre os indivíduos e ainda entre parentes cercanos) ou no nível populacional.
Mecanismos de origem e características dos polimorfismos genéticos
SNPs
Os SNPs representam a forma mais simples de polimorfismo genético, afetando uma única base do DNA. Embora nessa categoria estejam incluídas indels de úma única base, o termo SNP é mais comumente utilizado para falar de substituições de bases. Os estudos realizados até o momento em populações humanas mostraram que existem, em média, ~3-4 milhões de SNPs por genoma. Estudos em populações europeias mostraram ser esperado encontrar um SNP a cada 1250 pb. No caso de genomas africanos, essa frequência aumenta a um SNP a cada 1006 pb, um claro indicador da maior diversidade genética africana quando comparada à diversidade encontrada nos demais continentes.
Nomenclatura
Os SNPs são identificados por um número rs, do inglês Reference SNP. Ex.: rs334 (o SNP que determina a anemia falciforme).
Características
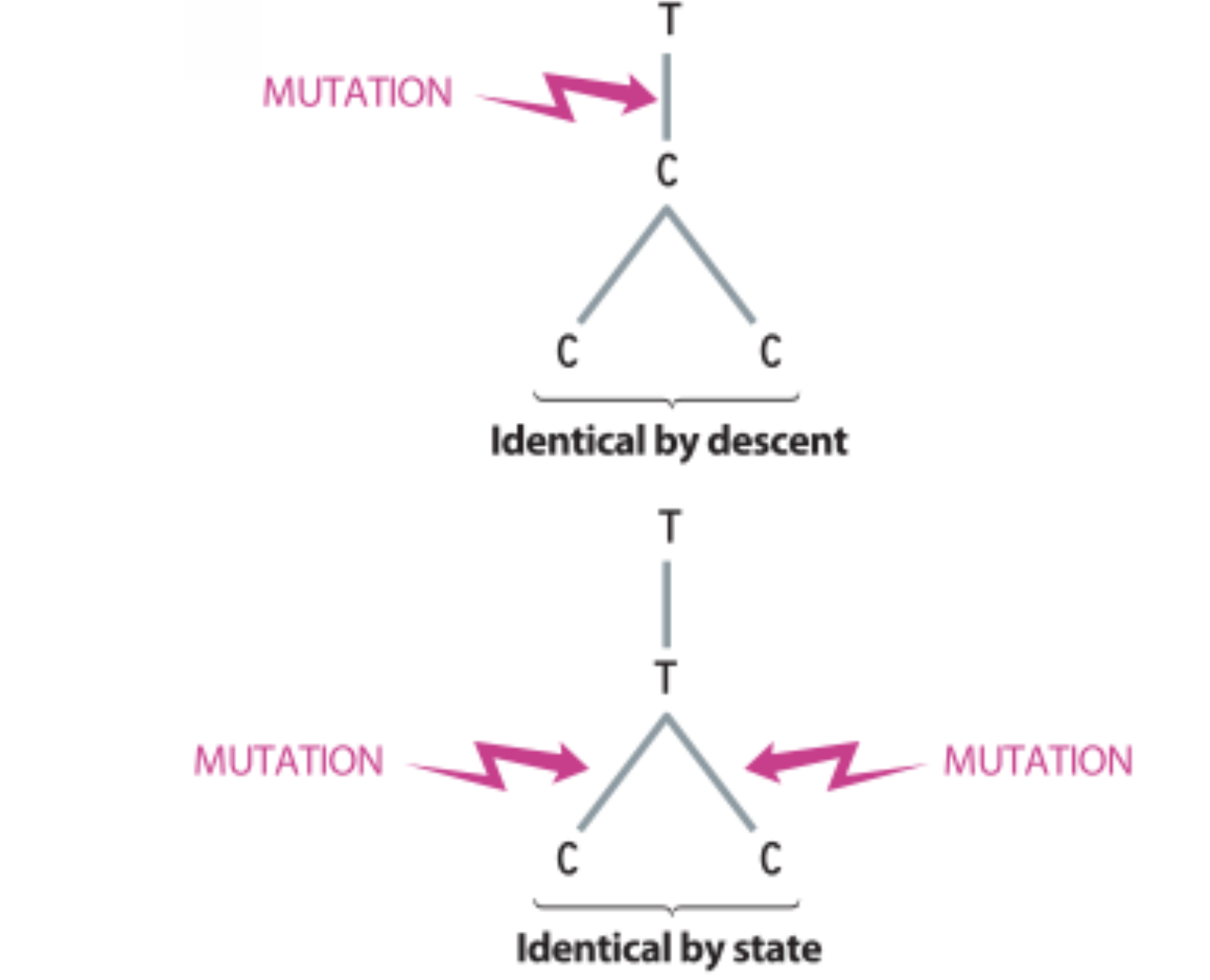
Os SNPs ocorrem em todos os cromossomos (autossomos, Y, X, DNAmt). Possuem uma baixa velocidade de mutação, motivo pelo qual, embora em teoria possam ocorrer 4 alelos por cada locus, os SNPs são comumente bialélicos. Os casos de SNPs trialélicos são raros, e, se ocorrem, o terceiro alelo é encontrado em frequências muito baixas e em populações específicas. Também em decorrência da sua baixa velocidade de mutação, os SNPs apresentam identidade por descendência (IBD, do inglês identity by descent). Isto significa que a existência do mesmo alelo de um SNP em dois indivíduos decorre necessariamente de ambos terem sido herdados de um ancestral comum. O alelo ancestral pode ser deduzido olhando o alelo existente nos grandes macacos. O alelo alternativo se denomina alelo derivado. Os SNPs são comumente descritos pelo MAF, ou Minor Allele Frequency, ou a frequência do alelo menos comum. Quando ambos os alelos ocorrem com uma frequência >= 5% se denominam variantes comuns.
O mecanismo de origem do SNP é uma mutação, que pode ser decorrente da ação de agentes mutagênicos exógenos, como agentes físicos (Ex.: radiações de alta penetrância nos tecidos como raios-X ou raios gamma) ou químicos (Ex.: brometo de etídeo, mitomicina C, etc). É importante destacar que, para que qualquer agente mutagênico externo possa dar origem a um SNP ele deve atingir a linha germinal, portanto deve penetrar os tecidos e chegar até as gonadas. Por outro lado, mutações podem decorrer de mecanismos endógenos, como erros durante a replicação do DNA. A ocorrência da mutação por si só não garante que a mesma será mantida, portanto, é necessário também que ocorram falhas no sistema de reparo.
Métodos de estudo de SNPs
Dentre os métodos utilizados atualmente para o estudo de SNPs podemos diferenciar entre aqueles que são específicos para este tipo de polimorfismo, como PCR-RFLP, PCR-SSP e microarranjo de DNA, e aqueles que são aplicáveis ao estudo de qualquer tipo de polimorfismo genético e que se baseiam no sequenciamento do DNA. Entre os métodos específicos podemos mencionar (embora não se limitam aos mencionados aqui):
PCR-RFLP: este método consiste em uma atualização do RFLP antes descrito, ao qual é incorporada uma etapa inicial de amplificação por PCR (do inglês Polymerase Chain Reaction) do fragmento de interesse, onde se encontra o sítio polimórfico. Após a amplificação, o produto de PCR é incubado com enzimas de restrição que reconhecem e cortam a sequência ao redor do SNP. A presença de um dos alelos evita o reconhecimento e o corte pela enzima, gerando um fragmento maior e reconhecível pelo seu tamanho em um gel de eletroforese. O gel pode ser então corado com corantes específicos de DNA. A prévia amplificação do fragmento permite que haja uma quantidade suficiente de DNA para que as bandas possam ser visualizadas em um transiluminador.
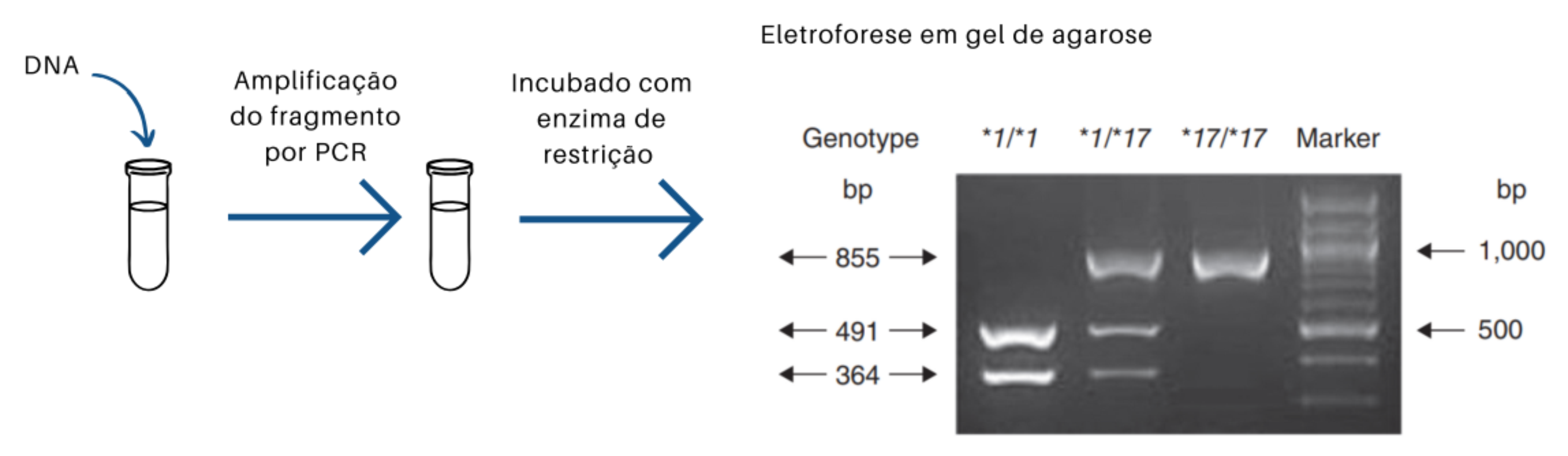
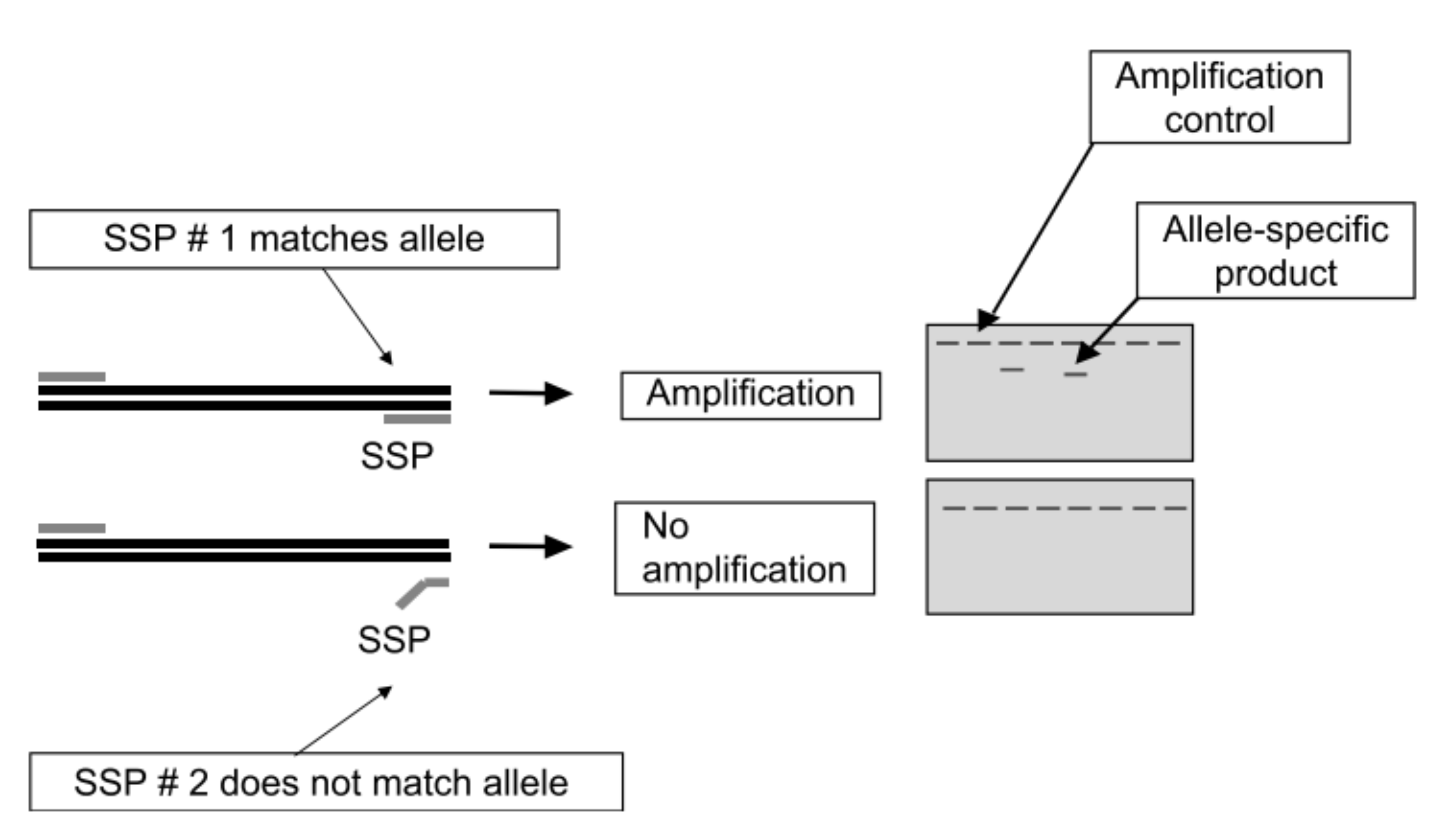
PCR-SSP: ou PCR com iniciadores específicos de sequência (do inglês, Sequence Specific Primer). Esta técnica utiliza iniciadores específicos para cada um dos alelos de um SNP em uma mesma reação de PCR. Desenham-se iniciadores cujos extremos 3 ́ devem hibridizar cada um com apenas um dos alelos do SNP, e um terceiro iniciador comum para ambas as reações. Após a reação os tamanhos dos fragmentos se visualizam por eletroforese. Assim, indivíduos homozigotos terão amplificação a partir de apenas um dos iniciadores, enquanto indivíduos heterozigotos terão amplificação a partir de ambos os iniciadores, observándo-se duas bandas no gel.
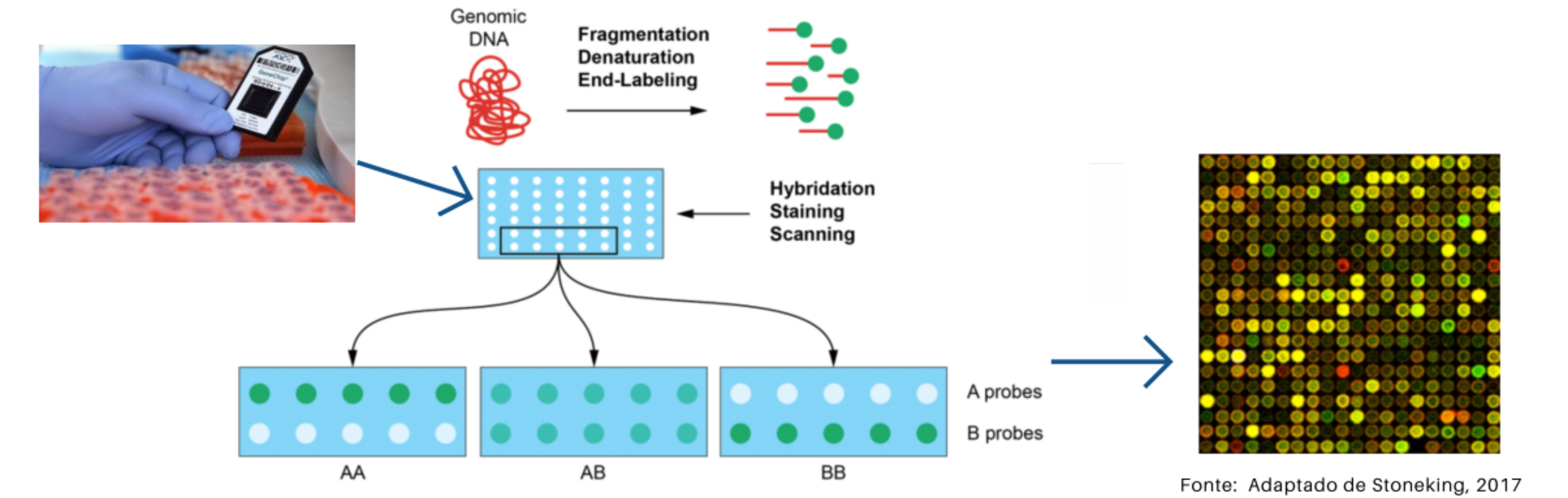
Microarranjos de DNA
Também chamados "chips". Os microarranjos permitem a genotipagem de milhares de SNPs para cada amostra, geralmente abrangendo "Tag" SNPs de todo o genoma (Genome-Wide). O termo Tag SNP (Tag provem do inglês e significa "etiqueta") faz referência ao uso de certos SNPs como marcadores de uma determinada região genômica, a qual é herdada "em bloco" por apresentar desequilíbrio de ligação. Assim, os SNPs que se encontram próximos são herdados em combinações de alelos ou haplótipos (um alelo do SNP1 sempre é herdado junto o com um certo alelo do SNP2), desta forma o conhecimento do estado alélico do Tag SNP (o SNP presente no microarranjo) pode nos informar dos estados alélicos dos SNPs que se encontram no mesmo haplótipo, mas que não foram genotipados no microarranjo. Os chips são produtos comerciais e desenhados para a genotipagem de conjuntos de SNPs pre-selecionados e, como consequência não permitem a detecção de novos SNPs. Em um chip, cada poço possui sondas marcadas com fluorescentes diferentes para cada alelo (verde ou vermelho). O sinal amarelo indica a hibridização com ambas as sondas (o indivíduo é heterozigoto para esse loco). Cada chip permite a genotipagem de uma amostra, mas eles são comumente vendidos por quantidades (>= 100 chips).
Técnicas de sequenciamento
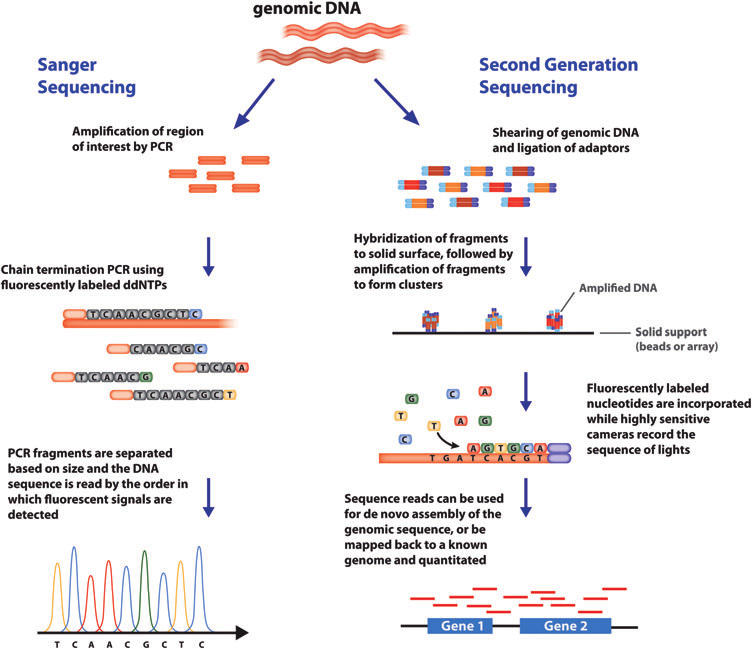
Sequenciamento de Sanger
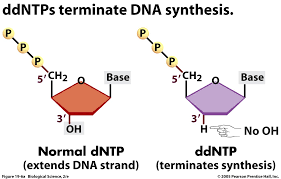
Este método também é conhecido como sequenciamento de primeira geração, método dos dideoxi ou de terminação de cadeia. A técnica permite detectar cada nucleotídeo na medida que este é adicionado
durante a reação de polimerização. Na reação de sequenciamento são utilizados dideoxi nucleotídeos (ddNTPs) marcados com um fluoróforo diferente para cada base (A, T, G ou C), assim como também dNTPs não marcados, estes últimos em maior concentração. Quando um ddNTP é adicionado pela DNA polimerase a reação termina, dado que o ddNTP não possui o 3´-OH necessário para a incorporação de um novo nucleotídeo na cadeia. É gerado assim um fragmento com o comprimento equivalente à posição do último nucleotídeo incorporado e uma cor específica para a última base. Ao final todos os fragmentos são separados em um tubo capilar e detectados pelo sequenciador. O resultado do sequenciamento é lido como um cromatograma onde cada pico representa um nucleotídeo da sequência.
Sequenciamento de nova geração (NGS = Next Generation Sequencing)
Também chamado de sequenciamento de segunda geração. O termo inclui vários métodos que diferem dependendo da empresa que oferece o serviço, já que este requere de um equipamento adequado. As características gerais do NGS incluem uma etapa de fragmentação do DNA genômico (que não precisa ser amplificado previamente como no sequenciamento de Sanger) e uma segunda etapa de imobilização dos fragmentos numa superfície sobre a qual será realizada a reação de sequenciamento. Esses métodos permitem sequenciar genomas completos ou grandes fragmentos e, inclusive, muitas amostras numa mesma reação. Novas abordagens permitem o sequenciamento apenas de regiões exônicas (codificadoras de proteínas).
Microssatélites (ou STR, do inglês Short Tandem Repeats )
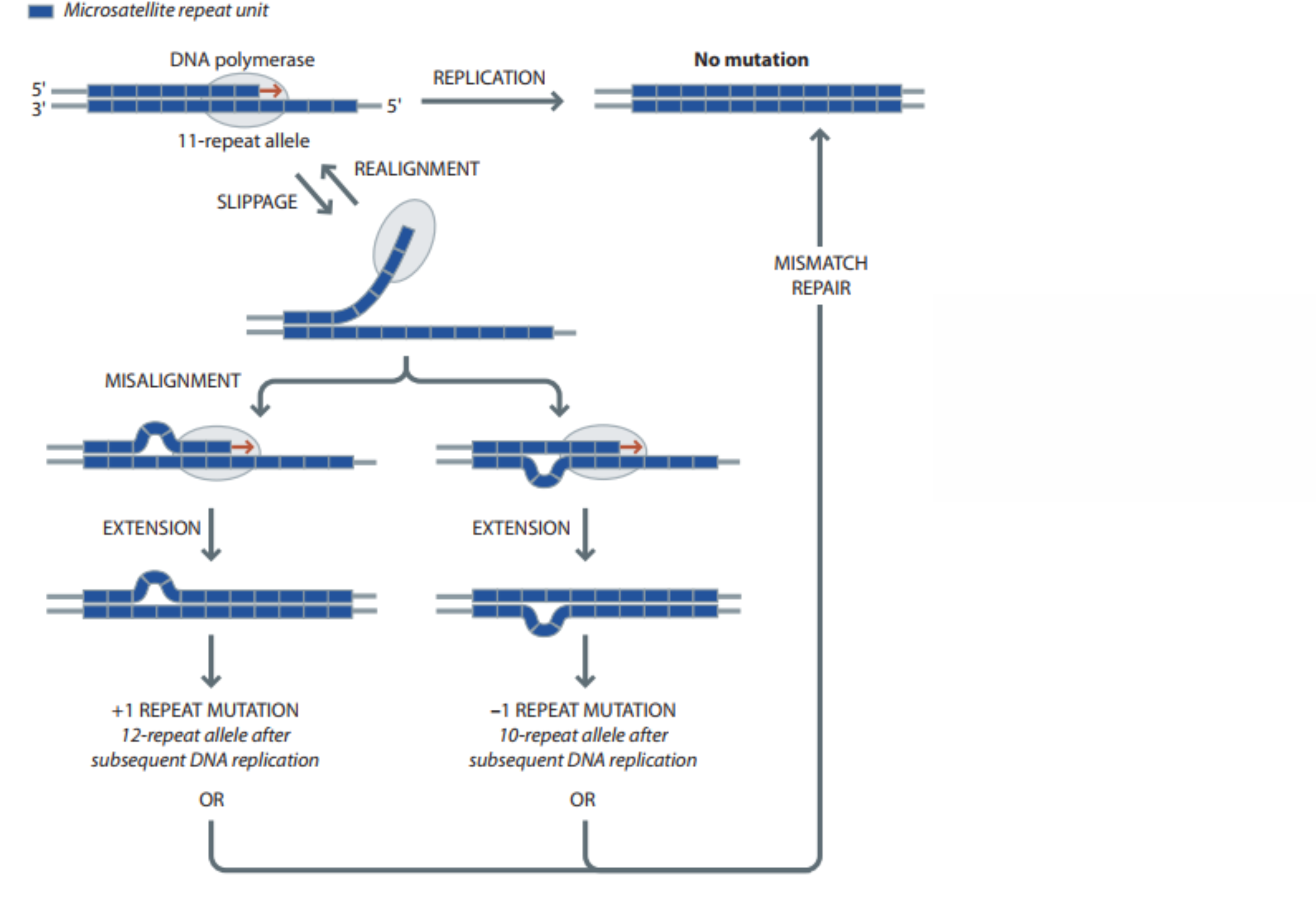
Os microssatélites são repetições de sequências de entre 1–7 bp que, usualmente, se encontram presentes em 10–30 copias. Ocorrem em todos os cromossomos humanos (autossomos, Y, X e mtDNA). Este tipo de polimorfismo possui uma alta velocidade de mutação, motivo pelo qual são comumente multialélicos, sendo os seus alelos os distintos números de cópias existentes. Devido a sua alta velocidade de mutação, alelos com o mesmo tamanho em distintos indivíduos não são necessariamente idênticos por descendência e, sim, idênticos por estado (ou seja, os mesmos alelos em distintos indivíduos originam-se por evolução convergente). Combinações de STRs podem produzir perfis genéticos únicos para um indivíduo, permitindo a sua identificação. Devido à ocorrência de evolução convergente nesses loci o alelo ancestral não pode ser deduzido olhando o alelo existente nos grandes macacos (pois o número de cópias pode ter-se reduzido o aumentando múltiplas vezes durante a evolução).
O mecanismo de origem dos STR são erros no alinhamento das fitas de DNA durante a replicação. Devido a sua natureza repetitiva, sequências microssatélites podem hibridizar consigo mesmas, gerando forquilhas e encurtando a fita. Se a fita onde se forma a forquilha é a mesma fita que está sendo polimerisada então um número de repetições proporcional ao número que compus a forquilha será adicionado. Se a fita onde a forquilha é formada é a fita molde, a cadeia replicada terá menos repetições que a cadeia original. Esses erros de alinhamento podem ser corrigidos pelo sistema de reparo, mas, se o erro não for reparado será gerado, no primeiro caso, um alelo com mais repetições e, no segundo caso um alelo com menor número de cópias.
Métodos de estudo dos microssatélites
A técnica fundamental de estudo de microssatélites é a PCR em combinação com técnicas adicionais como:
PCR + eletroforese: utilizam-se iniciadores que flanqueiam a região polimórfica. Após a amplificação, o produto de PCR é visualizado através de um gel de agarose e os distintos alelos são diferenciados pelo tamanho das bandas.
PCR + sequenciamento: um dos iniciadores da PCR é marcado com fluorescência no extremo 5 ́. Após a amplificação, os produtos marcados fluorescentemente são sequenciados em sequenciador capilar (o mesmo utilizado no sequenciamento de Sanger) permitindo a determinação do comprimento de cada fragmento. A marcação de distintos microssatélites com diferentes cores permite a sua genotipagem simultânea (técnica denominada multiplex).
Inserções Alu
As inserções da família Alu são os elementos repetitivos dispersos mais bem estudados.
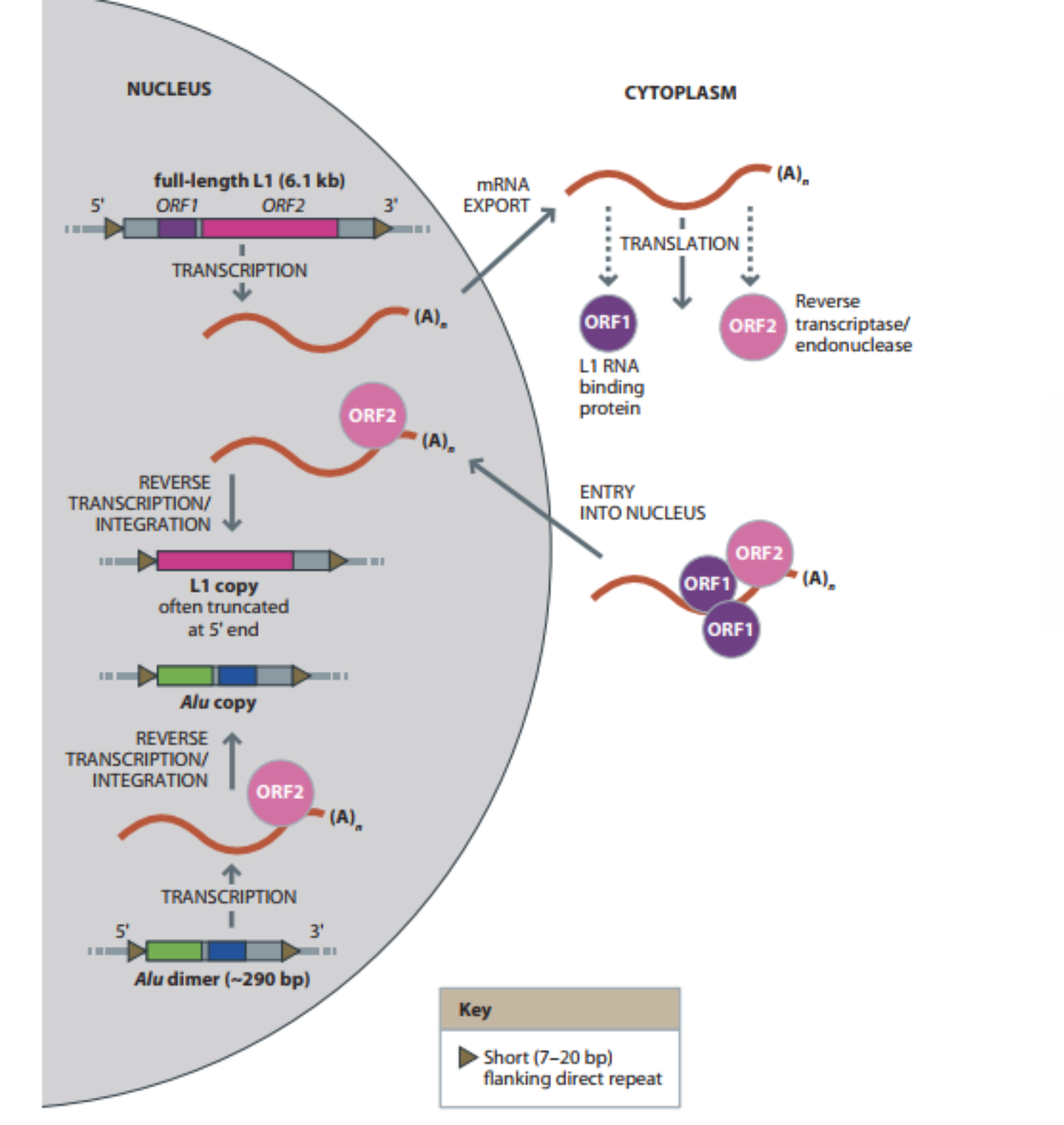
São retrotransposons curtos (~300pb) derivados de uma sequência original que se transpõe periodicamente a outras regiões do genoma. Transposições Alu têm ocorrido desde a origem dos primatas e por isso todos os humanos possuem certas cópias em regiões específicas do genoma (Alu não polimórficas ou fixas), enquanto outras ocorreram mais recentemente originando polimorfismo de inserção Alu (AIP). Nos humanos cerca de 10% do genoma é formado por esses elementos. A sua velocidade de transposição é muito baixa (ainda menor que a de SNPs) motivo pelo qual apresentam identidade por descendência. O estado ancestral é sempre a ausência da sequência Alu. Ocorrem nos autossomos e nos cromossomos X e Y. Existem >1 milhão Alus no genoma humano, mas apenas ~2000 são ativas.
Mecanismo de origem
As sequências Alu não codificam genes. Elas possuem sítios de reconhecimesão transcritas pela RNA polimerase III, quem realiza a sua transcrição. Para sua transposição elas dependem da maquinaria enzimática de um outro elemento transponível (L1). A endonuclease de L1 reconhece e corta uma sequência consenso gerando o sítio de inserção, enquanto a retrotrascriptase de L1 retrotranscreve o RNA Alu para DNA, que pode então ser inserido na nova posição.
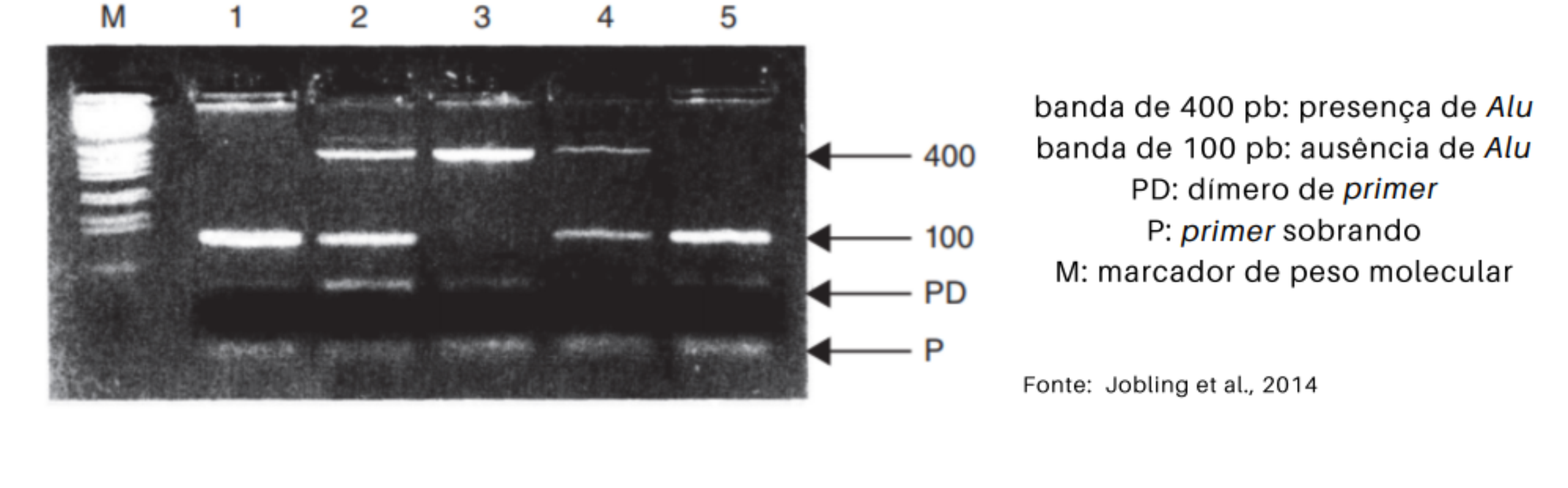
Método de estudo
Devido à presença de regiões consenso que flanqueiam o elemento Alu e a sua sequência relativamente curta, eles podem ser facilmente detectados por PCR + eletroforese em gel de agarose. Em presença da inserção, a PCR amplifica uma banda 300pb maior do que na ausência da mesma.